
01-宿主细胞蛋白(HCP)
中国药典(ChP)规定HCP残留量应不高于蛋白质总量的0.01%。美国药典(USP)规定单抗制品中残留HCP不得超过100 ppm,其它蛋白类药物其所允许的HCP一般也低于100 ppm。

02-HCP残留检测方法
商品化的ELISA试剂盒中的多克隆抗体能够识别大多数HCP混合物中的蛋白质,但可能无法检测特定制造过程中的HCP成分。通过ELISA法检测HCP残留的准确性主要依赖于多克隆抗体对HCP的覆盖率。因此,监管机构要求在治疗性蛋白产品在商业化申报之前,用于检测HCP残留的多克隆抗体对于产品中HCP的覆盖率需要经过验证。

03-HCP抗体覆盖率验证
3.1. HCP 抗体覆盖率检测方法
USP <1132>章节阐述了两种用于测定ELISA试剂盒中多克隆抗体对HCP覆盖率的方法,一种是二维凝胶电泳后连用免疫印迹分析(2-D SDS-PAGE/Western blot, 2D-WB),另一种是免疫亲和结合后连用凝胶电泳技术(Immunoaffinity binding/1- or 2-D SDS-PAGE)。第一种方法通过对比免疫印迹染色点数与经荧光染色或银染获得的总蛋白点数来获得抗体覆盖率(如Figure 1所示)。第二种方法通过对比样品从固定了HCP抗体的凝胶柱上流穿和洗脱的蛋白数量计算抗覆盖率。

Figure 1- Left panel: 2-D IEF/SDS-PAGE analysis of representative CHO HCP calibration standard stained with a sensitive fluorescent. Right panel: Western blot analysis of the same gel shown in the left panel. (Excerpt from USP <1132>)
3.2. 双向差异荧光印记法(2D-DIBE)
双向差异荧光印记法(2D-DIBE)是测定ELISA试剂盒中抗体的覆盖率的常用方法,是2D-WB方法的改进,其主要的操作步骤如下。
HCP首先通过第一维的等电聚焦电泳依据等电点分离带不同性质电荷的蛋白,随后转移至第二维的SDS-PAGE凝胶电泳,依据蛋白分子量大小不同进行分离。经过两个维度的电泳分离,极大的提高了HCP的分离效果。
二维凝胶电泳原理如Figure2所示:
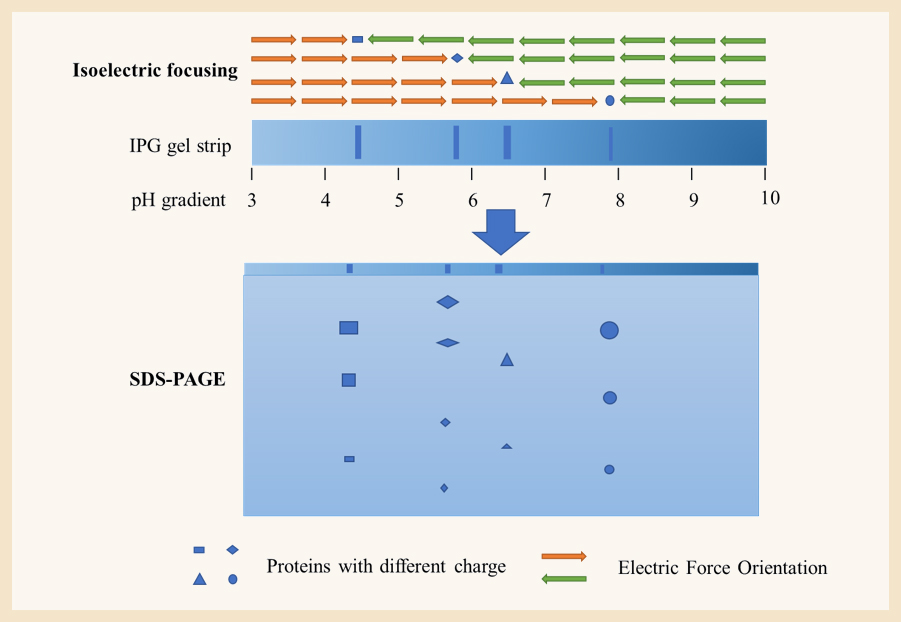
Figure 2 - Schematic of Two-dimensional gel electrophoresis
Western blot原理如Figure3所示:
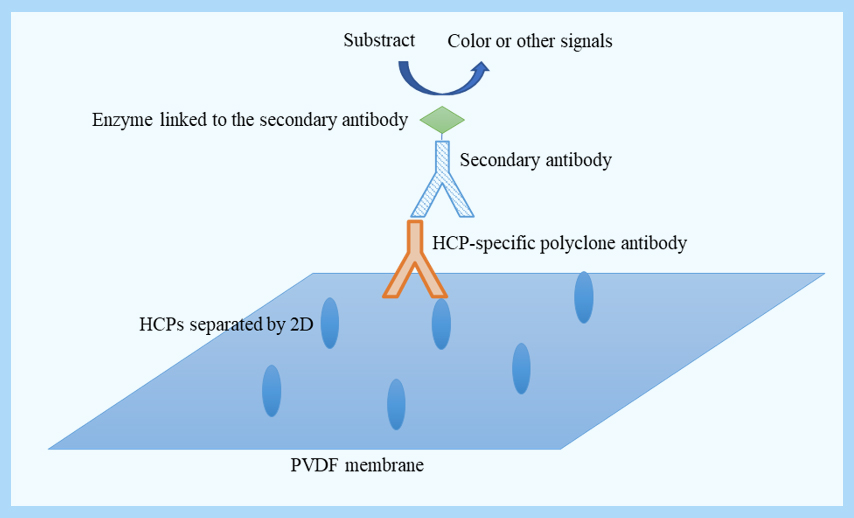
Figure 3 - Schematic of Western blot
由于蛋白荧光信号和与HCP抗体结合的二抗信号在同一张膜上显示,避免了两张膜不同分离效果带来的差异。可以利用软件方便的进行图像叠加和数据分析,准确匹配两者重合的点数并计算抗体覆盖率:
总蛋白点数=SYPRO Ruby染色识别点数+Western blot信号点数-两者重合的点数
抗体覆盖率= Western blot信号点数/总蛋白点数×100%
04-赋成生物HCP抗体覆盖率验证平台介绍

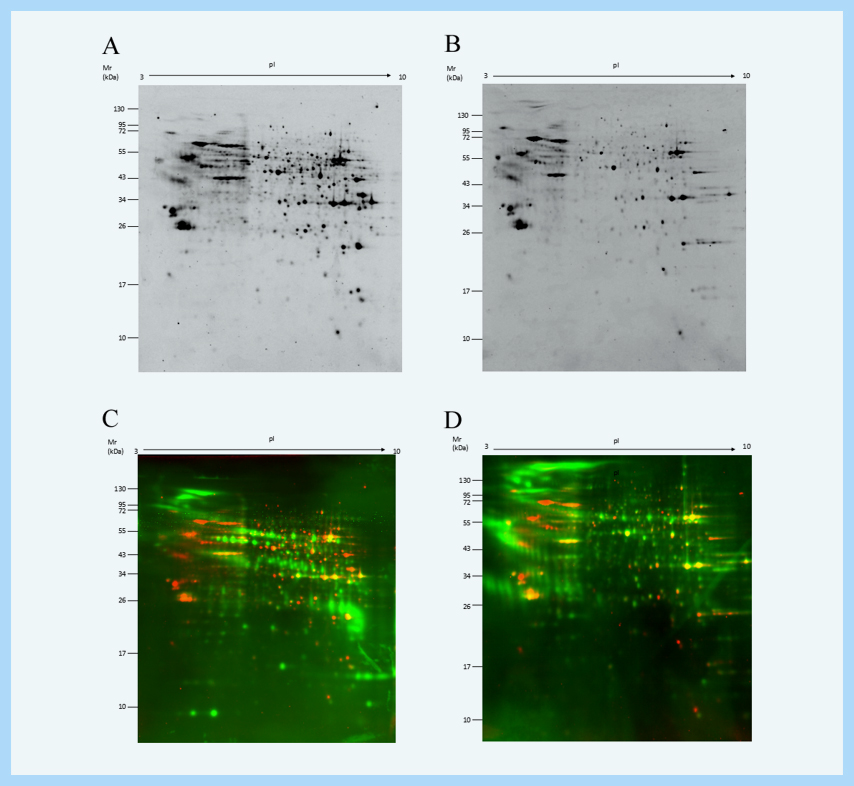
(A: SYPRO Ruby detection profile of Kit 1; B: SYPRO Ruby detection profile of Kit 2; C: Western blot detection profile of Kit 1; D: Western blot detection profile of Kit 2 )
( Red signal: SYPRO Ruby signal; Green signal: Western blot signal )

参考文献
[1].Slaney, Thomas, Song, et al. Identification of a host cell protein impurity in therapeutic protein, P1[J]. Journal of Pharmaceutical and Biomedical Analysis: An International Journal on All Drug-Related Topics in Pharmaceutical, Biomedical and Clinical Analysis, 2017;32-38.
[5].国家药典委员会. 中华人民共和国药典(2020年版):三部, 尼妥珠单抗注射液[M]. 北京:中国医药科技出版社,2020.







