
与传统小分子药物不同,生物制品由于起始原材料来源于微生物或人/动物源的细胞、组织和体液,其制备过程或制剂中可能添加人或者动物来源的原辅材料,具有潜在的受病毒污染的风险,因此国内外均对其病毒安全性提出了明确的法规要求。其中比较常见的生物制品是中国仓鼠卵巢细胞系(CHO细胞)。

作为啮齿类动物细胞,CHO细胞常表达内源性逆转录病毒样颗粒,细胞上清液中可检测到103 - 109 个/mL的逆转录病毒样颗粒。这些颗粒的形态、生化特性和序列与传染性逆转录病毒相似,外源性病毒污染可能发生在CHO细胞培养过程中,各国的药物监管机构要求,必须通过临床前和生产前申报材料中的病毒去除/灭活来核实,以确保注射用临床试验病人或上市产品不会发生病毒污染。生物制品病毒安全性控制对于保证药品的安全性和有效性具有重要意义。
██ 国内外病毒安全性法规/指南
病毒安全的法规涉及单抗,血液制品,疫苗,基因和细胞治疗等领域, 世界各主要监管机构均已陆续针对性地制定、 发布关于重组生物技术产品中病毒安全性研究相关指导原则。
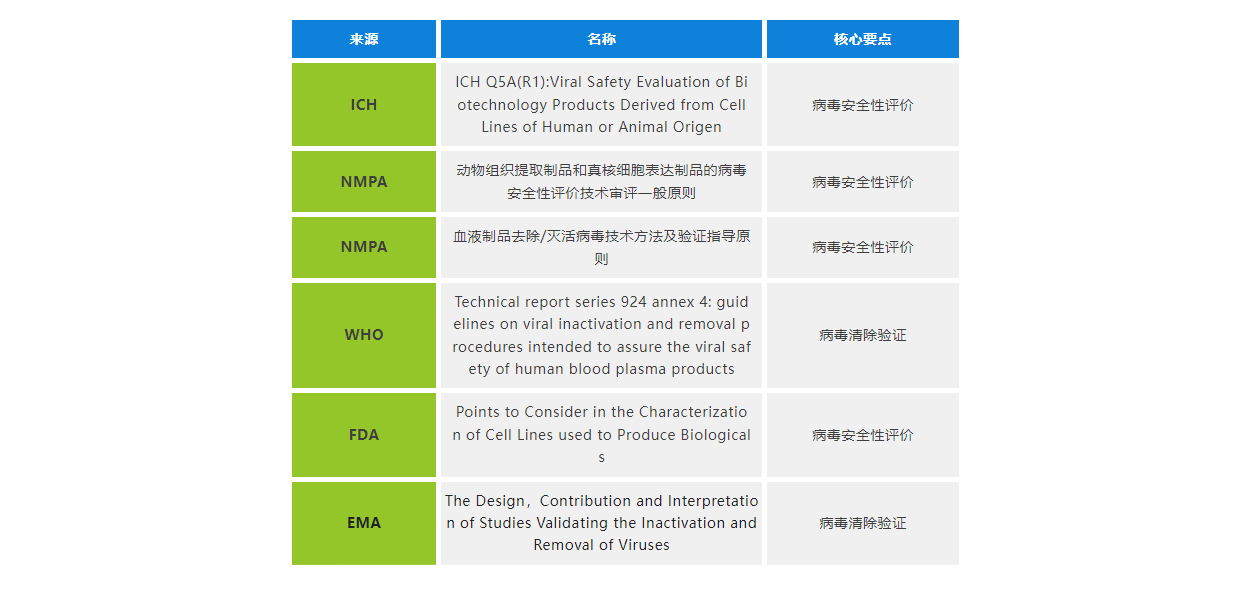

从《中国药典》2020年版的新增章节来看,国内法规的要求是走在世界前列,例如首次提出对基因治疗产品病毒安全性的要求。《中国药典》2020年版对病毒安全性提出了更高的要求,如“应明确影响病毒清除效果的关键工艺参数及控制范围”,需要生产单位对生产工艺的病毒清除能力有更全面的了解,必要时需要通过实验,来评价工艺中对病毒清除效果有关键影响的因素,明确关键工艺参数的操作区间,特别是针对病毒清除效果的“最差工艺条件”。
从法规的沿革来看,《中国药典》2020年版对病毒清除的要求,正加速与ICH的指导原则相融合。全球不同地区对病毒安全的法规要求,也有明显的趋同性,这些变革都是在过往多年生产实践经验的基础上,逐步总结出来的。
CDE 2005年发布的《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》、《中国药典》2020年版、《生物制品病毒安全性控制》和ICH Q5A 都有不同的侧重点,在具体执行的过程中,我们建议参照各个指导文件的最高标准,结合针对实际工艺的风险评估,来开展验证工作。因为CDE要求适用ICH原则,并没有说2005版的原则不再适用。

██ 生物制品病毒的来源及安全控制

《中国药典》2020年版代表了国内病毒安全最先进的要求, ICH Q5A是国际上通用的病毒安全指导原则。国内、ICH和欧美在保证药品病毒安全性的基本原则是一致,可归纳为以下三条相互联系互补的原则:
(1)预防:筛选和检测用于制备产品的细胞系和其他原材料,确保所有进入细胞培养罐的物质:包括细胞、细胞培养基和添加成分没有病毒污染;
(2)检测:在细胞培养结束时进行病毒检测,保证在细胞培养过程中没有任何病毒污染;
(3)清除:纯化工艺清除病毒验证,证明纯化工艺能清除已知病毒。
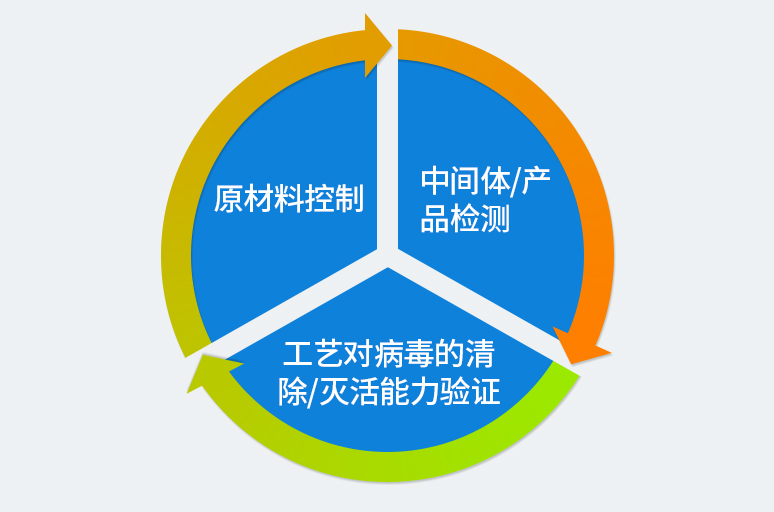
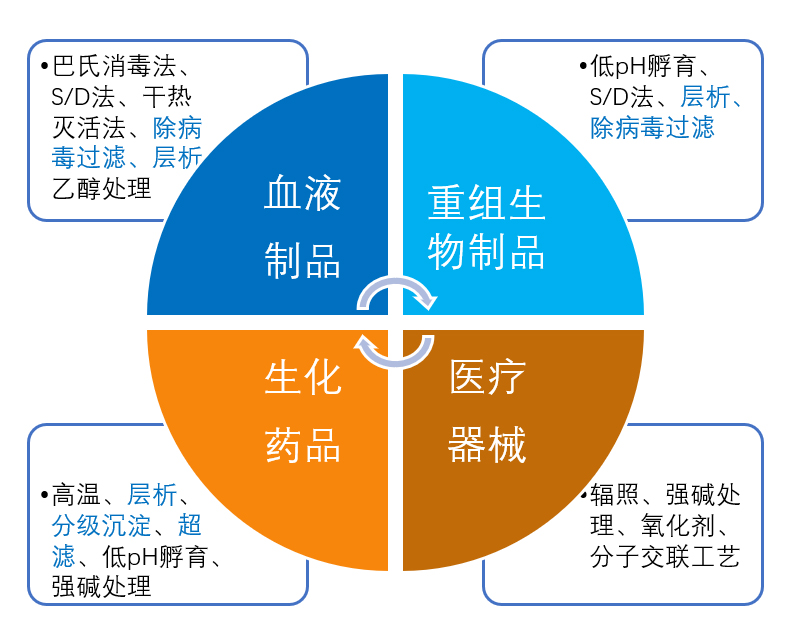
██ 不同类型生物制品病毒安全性控制要点

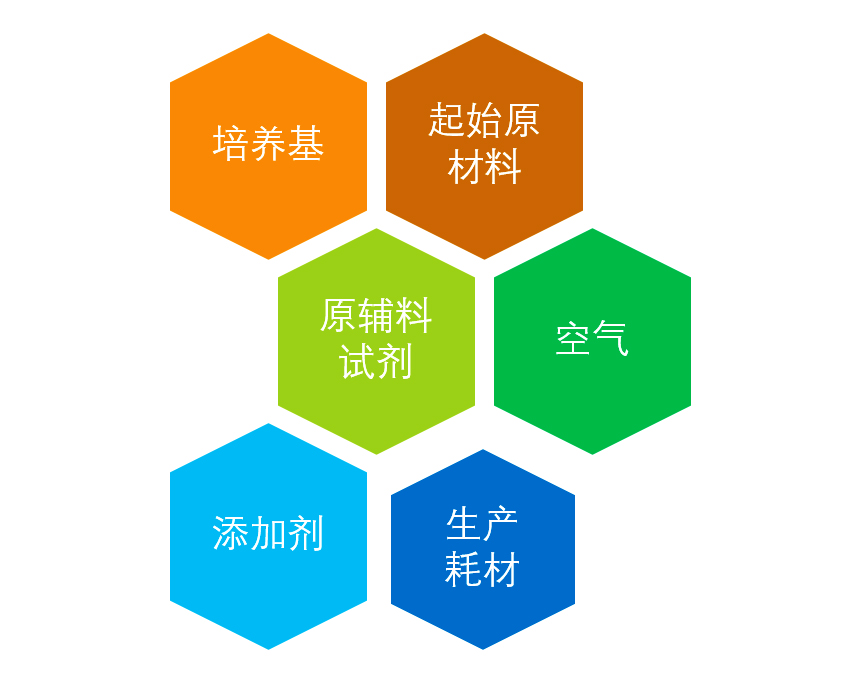
██ 原材料的病毒安全控制
相较于小分子药物而言,生物制品生产过程中使用的各种材料来源复杂,可能引入外源因子或毒性化学材料。因此,对生物制品生产用原材料和辅料进行严格的安全质量控制,是降低外源因子或有毒杂质污染风险、保证生物制品安全有效的必要措施。

██ 工艺过程的病毒安全控制
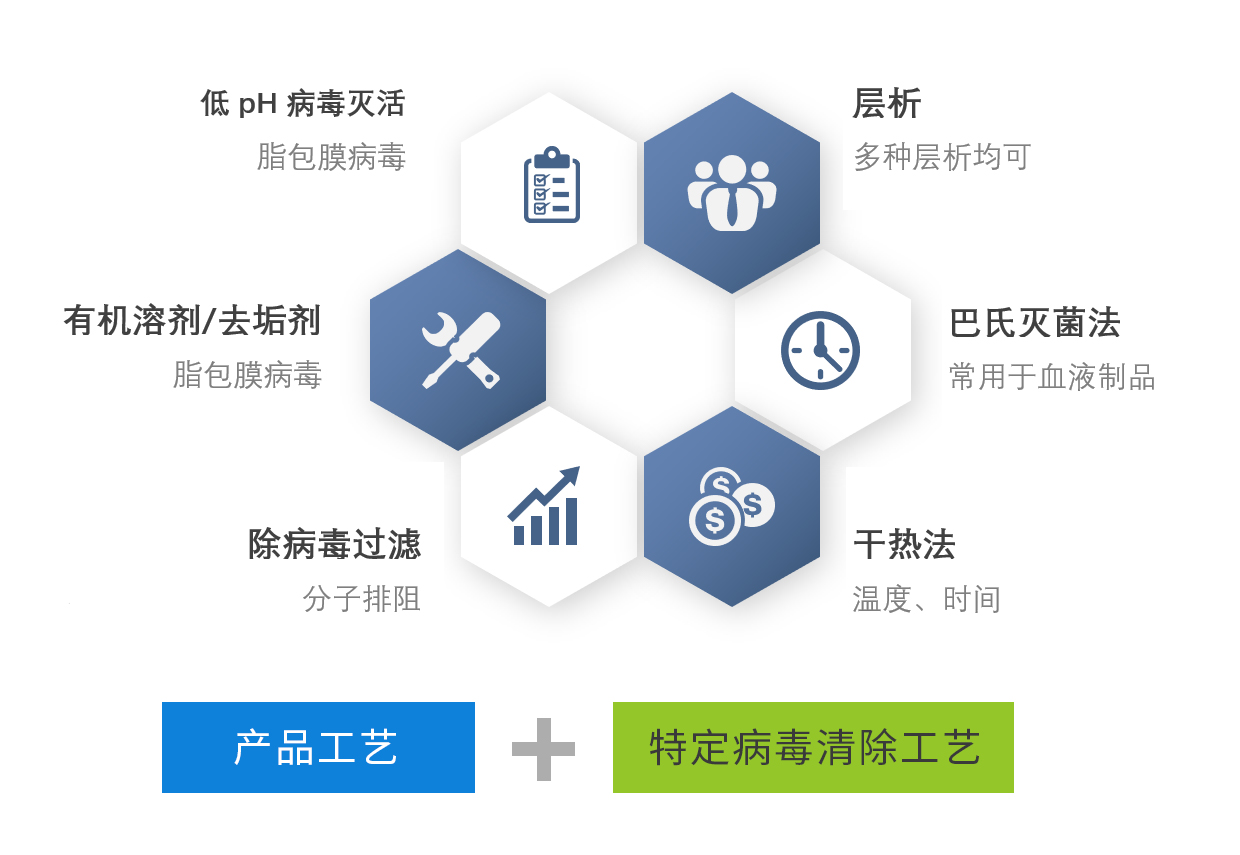
██ 不同生物制品病毒清除方法
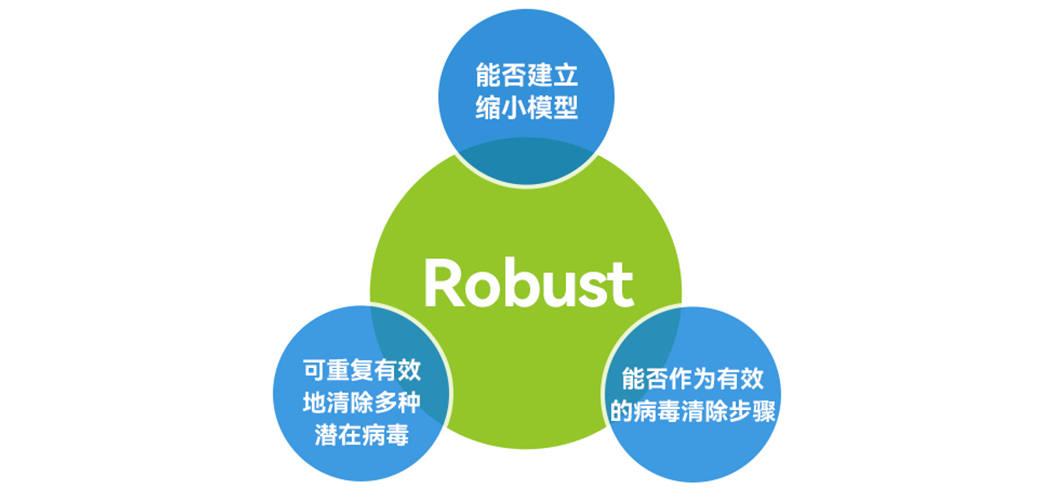
██ 如何确定选择合适的病毒清除工艺?
生物制品病毒安全性控制与评价是生产中重要的研究内容,需要在生产中严格落实病毒安全性控制策略,通过来源控制、过程检测以及病毒清除工艺验证,切实保障用药安全。







